Потенциометрическое титрование |
|
+7 (383) 358-68-69; semico@mail.ru |
Контакты
|
Прайс-лист
Главная / Лабораторное оборудование / Приборы МУЛЬТИТЕСТ / Методы |
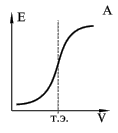
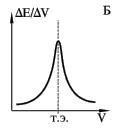
Потенциометрическое титрование основано на определении точки эквивалентности по результатам потенциометрических измерений. Вблизи точки эквивалентности происходит резкое изменение (скачок) потенциала индикаторного электрода. Это наблюдается, конечно, лишь тогда когда хотя бы один из участников реакции титрования является участником электродного процесса. Так, например, титрование по методу кислотно-основного взаимодействия может быть выполнено со стеклянным электродом. Определение хлорида - с хлорсеребряным и т.д. Так же, как и в других титриметрических методах, реакции потенциометрического титрования должны протекать строго стехиометрически, иметь высокую скорость и идти до конца. Для потенциометрического титрования собирают цепь из индикаторного электрода в анализируемом растворе и электрода сравнения. В качестве электродов сравнения чаще всего применяют каломельный или хлорсеребряный. Определение точки эквивалентности
Виды потенциометрического титрованияКислотно-основное титрованиеВ кислотно-основном титровании в качестве индикаторного обычно используют стеклянный электрод, как правило, входящий в комплект серийно выпускаемых промышленностью pH-метров. Потенциометрический метод позволяет провести количественное определение компонентов в смеси кислот, если константы диссоциации различаются не менее чем на три порядка. Например, при титровании смеси, содержащей хлороводородную (HCl) и уксусную кислоты, на кривой титрования обнаруживается два скачка. Первый свидетельствует об окончании титрования HCl, второй скачок наблюдается при оттитровывании уксусной кислоты. Также несколько скачков имеют кривые титрования многоосновных кислот, константы диссоциации которых существенно различаются (хромовая, фосфорная и др.). Широкие возможности анализа многокомпонентных смесей без разделения открывает применение неводных растворителей. Например, определение содержания хлороводородной и монохлоруксусной кислот в смеси титрованием водного раствора является сложной задачей в связи с трудностью обнаружения двух скачков титрования. При титровании в ацетоне оба скачка выражены достаточно четко и содержание каждой кислоты в смеси может быть рассчитано. Комплексонометрическое титрованиеПотенциометрическое титрование катионов комплексоном III (ЭДТА) можно проводить с использованием в качестве индикаторного электрода соответствующего металла: титрование солей меди с медным электродом, солей цинка с цинковым и т.д. или подходящего ионоселективного электрода. Однако, многие металлические индикаторные электроды необратимы, а число ионоселективных электродов невелико. Для комплексонометрических титрований может быть использован универсальный электрод Hg|HgY2- или Au(Hg)|HgY2- где Au(Hg) - амальгамированное золото; HgY2- - комплекс ртути с анионом этилендиаминтетрауксусной кислоты. С помощью ртутного электрода этого типа могут быть оттитрованы любые ионы, которые образуют с Y4- комплексы с константой устойчивости, не превышающей константу устойчивости ртутного комплекса. Это, например, ионы магния (Mg2+), кальция (Ca2+), кобальта (Co2+), никеля (Ni2+), меди (Cu2+), цинка (Zn2+) и др. Титрование по методу осажденияИндикаторными электродами в методах потенциометрического титрования, использующих реакции осаждения, служат металлические или мембранные электроды, чувствительные к определяемому иону или иону-осадителю. Практически по методу осаждения могут быть определены катионы серебра, ртути, цинка, свинца, анионы хлора, брома, иода и некоторые другие. Смесь галогенидов, например I- и Cl-, может быть оттитрована без разделения нитратом серебра. Серебряный электрод позволяет фиксировать два скачка в ходе такого титрования. Первый скачок свидетельствует об оттитровывании иодид-иона и может быть использован для расчета содержания этого иона, второй скачок относится к окончанию осаждения хлорид-иона. По второму скачку можно рассчитать суммарное содержание галогенидов или концентрацию хлорид-иона, если концентрация иодид-иона будет известна из данных по титрованию до первого скачка. Окислительно-восстановительное титрованиеКривые окислительно-восстановительного титрования могут быть построены в координатах или pM - V (титранта) или E - V (титранта), если pM=-lg[M] ([M] - концентрация участника реакции, E - потенциал системы, V (титранта) - объем титранта. Кривые титрования первого типа представляют практический интерес, когда имеется индикаторный электрод, чувствительный к M. Кривые второго типа имеют более общее значение, так как любое окислительно-восстановительное титрование может быть проведено по измерению E с использованием индикаторного электрода из благородного металла, чаще всего платины. Васильев В. П. Аналитическая химия. В 2 кн. Кн. 2. Физико-химические методы анализа: Учеб. для студ. вузов, обучающихся по химико-технол. спец. - 2-е изд., перераб. и доп. - М.:Дрофа, 2002. - 384 с., ил. - С. 202-207. Для проведения потенциометрического титрования удобно использовать специализированные приборы - автоматические титраторы (автотитраторы). В серии приборов МУЛЬТИТЕСТ есть специализированные автоматические титраторы ИПЛ-101-1 и ИПЛ-111-1. Эти приборы могут работать в двух режимах. При работе в режиме pH-метра/иономера прибор управляет релейными выходами, которые могут сигнализировать о выходе величины ЭДС или концентрации за ранее установленные пределы. При работе в режиме титратора, прибор самостоятельно управляет дозирующим устройством и осуществляет титрование до конечной точки, заданной в величинах ЭДС (потенциала) или pH (pX). Блок автоматического титрования БАТ-15 для управления дозирующим устройством не требуется. В обоих режимах работы прибор может выдавать результат измерения на аналоговый выход (на самописец или аналогичное устройство) или передавать их в компьютер. При титровании для построения графика и обработки результатов можно использовать соответствующее программное обеспечение. |
||||||||
|
НПП "СЕМИКО" (383) 271-01-25 (многоканальный) |